[Top Page]�ցA[Set-TopPage]�ցA ���������w[Gallery]���A �זE�����w�K�̎�u�����A�o�[�`�����������ώ@��[�̂̊�{10����] �� �A [�����F���_�ꗗ]�ց@[�}�N���g�D�̘b������]���A [�זE��������W]�ցk�w�K�}�g���b�N�X�l�ցA���u�`�֖߂�F �u�`�P�ցA �u�`�Q�ցA �u�`�R���@ [�g�D�w����g��]��
��Set�R�F �͂��߂̈���̍זE�����F�J�o�[�K���X(CG)�|�{�@��
���� ���ł��E�ǂ��ł��E����ł��\�ȍזE�|�{�����FDIY�o�C�I�זE���� ����
���� �זE�����ECG�|�{�̖ڎ��� ����2018CG�זE�����@�F�}���W ����
���݂�CG�זE�����@�̐}������W�́u�R�R���N���b�N�ňړ��v�ŎQ�Ƃł��B
�ʃV�[�g�Ȃ̂Łu�u�b�N�}�[�N�v�ȂǂŖ��H�Ă��������B
| �T �v�F�����Ă��铮���זE���J�o�[�K���X�ɓH��/�|�{����ƁA�זE�͎����I�ɐڒ����^�����J�n����B��{�I�Ȑ����ɏ]�����ԂƋ����I�Ɋ�������B���̎����ł͂��̐������m�F���A�X�ɁA�����ȍזE�ɑ傫�ȃV���{���i�C�ӂ̊G�����j����点��B���E�ɂЂƂE���������̋M�d�ȍזE�W�{�F����Ċy�����E�l���ĉ����[���זE�����w�����B���̌o���l�͐����w�Ƀ��A���e�B�[��^���A��{�P�ʂ̊ȒP���L���\�Ƃ��A�w�K�\�����x���̃����������X�b�L���ɕϊ�����B�v���E�ȕցE�m���E�ȃG�l�E��R�X�g����Ȃ�u�זE�����L�b�g�v�ɂ������w�K�́u�l���鐶���w�v�̔����J���ADIY�o�C�I/�זE�����Ɋ�Â����u���C�E���匤�r�����\�Ƃ���B |
�@�@�����̃V�[�g�̖ڎ��ցA�זE������u�҂ցF��������ƌ��� �ցF2018�����w���A�g�D�w�ց�
| �� �{�ҁu�l���鐶���w�F�זE�����Ɋ�Â������w�v�͉��L�uSet 1�`�U�v�Ɋ�Â����{�����B �� Set-Top��Set 1�ł́A���K�u�`�̊T�v�������BSet2�[Set5�͍זE�����̎��{�v���ł���B �� ���p�l���u�b��W1�`�U�v�́A�זE�����w�K�Ɋ�Â������̂̐��藧���Ɋւ��b��i����j�B |
||||||
| Set-Top | Set�P�� | Set�Q�� | Set�R �@:�R�R |
Set�S�� | Set�T�� | Set�U�� |
| �{�҂� �ڎ��� �i���L�j |
�{���K�� ��Ȏ��{ �ۑ�Ƙb�� |
�V�I���� �זE�W�{�ώ@ �F�\���Ɗώ@ |
�זE�|�{���� (�ޗ��ƕ��@) |
�זE���� �@�̈Ӗ��Ӌ` �@�F12�� |
�זE���� �F���{�v�� �F�������@ |
�z�z���� �e�L�X�g ���[�N�V�[�g |
| Set-Top�ւ� �N���b�N�ňړ� |
Set1�ւ� �N���b�N�ňړ� |
Set2�ւ� �N���b�N�ňړ� |
���̃V�[�g ���̖ڎ��� |
Set4�ւ� �N���b�N�ňړ� |
Set5�ւ� �N���b�N�ňړ� |
Set6�ւ� �N���b�N�ňړ� |
| ������}�j���A��:PDF�͂������N���b�N�A����A�u�P��CG�|�{�����v�����́uPDF�}�j���A���̓R�R�v�� �������@�́u�T�v�E�C���[�W�v���m�F�� �R�R�FFig.42 - 60 �e�ʂ��傫������ꍇ�FPDF�S��������}�j���A���F����1,�@ ����2, �@����3�A�@���̂S |
||||||
���擪�s�ֈړ��F�ڎ��ց�
��Set 3�F�͂��߂̈���̍זE�|�{�����F�J�o�[�K���X(CG)�|�{�@���@
| �������ł�/���̃V�[�g�́A�זE�|�{���� Exp.A & B�́u�ޗ��ƕ��@�v�ł��B�� ���{�v��/�ޗ��̓���/���i�������@�Ȃǂ� �u��\��Set �T���N���b�N�v�i���̂T�ł̓_���j |
| ���ӁE�d�v �P�j�͂��߂ɁACG�זE�����̊ȒP�}�j���A���i�R�R�j�A���邢�́A����A�i�P��CG�|�{�����j������PDF�}�j���A���i�R�R�j���Q�Ɓi����j���A���J�Ɏ������@���Q�Ƃ��Ă��������B �Q�j��u�ґ����̎��Ǝ����������{����ꍇ�́A�K���u�ŐV�ł�PDF�����}�j���A���v���Q�ƁE������Ďg�p���Ă��������B �R�j���H�����w�K�ł͗l�X�Ȃ��Ƃւ̔z�����s���ł��B������v�搫�i���{�v�́j���K�v�Ȃ̂ŁuSet 5�F�R�R�v��K���Q�Ƃ��Ă��������B |
�@���{�V�[�gSet 3�̖ڎ���
�@1. �͂��߂�
�@���̃Z�b�g�̊T�v �i�C���[�W�c���p�F�ȒP�}�j���A����PDF�j
�@2. �������Z�̊T�v�F�J�o�[�K���X��|�{��Ƃ����זE�|�{�Ƃ�
�@�FA,B�̔�r�i��{�S�H���j
�@3. ���Z����}�j���A��
�@�E�E����A�i�P��CG�|�{�j & ����B�iOEKAKI�����j
��ȍޗ��A�������{�̃|�C���g�A
�H���ʂ̍ޗ��\�i�ޗ��̎ʐ^�j
�@�@�@�@���Z����FStep 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5�i�����@�j�A�זE�ώ@��
�@�⑫�P�F�����w�K�ɗp����
�@�u���Z�f������p�̃X���C�h�}���v��Fig.42 - 57�F�R�R�A
�@�⑫�Q :��������PDF�����}�j���A��
�@�i����1, ����2, ����3�A���̂S�j�A����X�y�[�XA4�p��
Step 1. �J�o�[�K���X(CG)�̏����A�@
Step 2. �זE�t�̒����i�זE�̉��S�ĕ��V�j�A
Step 3. �זE�t�̓H���E�|�{�A
Step 4. �Œ�E���F�i�W�{�����j�A
�Ō�ɁAStep5. �������ώ@
�����F�{�Z�b�g�L�ڂ̎����@�́u�����w�K�Ɍ������T�v�Ǝ��Z����}�j���A���v�ł���B
�d�v�F�זE�����w�K�̎��{�v�́A�ޗ��̈Ӗ��E�Ӌ`�E�d�l�A�ޗ��Z�o�@�E����@�Ȃǂ́u�Z�b�g�T�v�ɋL���B
�����}�j���A���̋L�ڂ́uShowing�v��K�v�Ƃ���B�s���Ȃ��Ƃ�����ΐ��������₭�������B���擪�s�ֈړ���
��1. �͂��߂Ɂ�
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.0 �@�@�� Fig.00 �@�@�E Fig.000)�@
���擪�s�ֈړ����E�������ڎ�����
���̃Z�b�g�̊T�v
�@���̃Z�b�g�i�V�j�ł́A���ލזE�iFHLS�j�ɂ���זE�|�{�������s���܂��B�O�̃Z�b�g�uSet2 �זE���F�W�{�̊ώ@�v�ɗp�����זE�W�{�i�V�I�����W�{�ȂǁF��}��Fig.0�j�̍Č������i�܂�ACG�זE�|�{�����j�ł��B���̐��F�W�{�̊ώ@�E�l�@���s�������A�^��⎿��Ƃ������ƂŌ��؉\�Ȃ��Ƃ́A���̃Z�b�g�Ōv������Ƃ��Ď��{���A�^��̉����ɓw�߂܂��܂��傤�B
�@�s�������́A����A�i#2�W�{�F�P��CG�|�{�ɑΉ��j������B�i#1�W�{�FCG���G�`�������ɑΉ��j�̂Q�敪�ł��B���Z����i�\3.1�j�͂ǂ�����P���ł����A���w�҂����������ɍs���ƍ������܂��B�܂��A����A��B�ł͂��̔|�{���Ԃ����Ȃ�قȂ�܂��B���{����O�ɂ́A�H���敪�ɏ]�������\�ȃ^�C���X�P�W���[�����쐬���Ă��������B�܂��A�����Ă���זE���������߁A�����̒��ӂƒ��J�ȑ�����K�v�ł��B
�@�Ȃ��A�זE�|�{�Z�p�͈�ʓI�ɂ��Ȃ���I�Ő�p�̐ݔ�����i�|�{�V���[���Ȃǁj��K�v�Ƃ��܂����A�����ł͎����w�K�p�ɊJ�����ꂽFHLS�זE�Ƃ��̍זE�����L�b�g��p���܂��B�܂�A�Z���Ԃł��J��Ԃ��Ď������\�ȃV�X�e���ł��B�w�K���ނȂ̂ŁA���s�����ꂸ�A�C�y�Ɋ��W�����A�J��Ԃ��A�����Ă��������B
�@���ꂼ��̎����ɗ^����\��́AExp.A�́u�P���J�o�[�K���X�iCG�j�|�{�����F�����זE��H���|�{����Ƃǂ��Ȃ邩�H�v�AExp.B�́u���G�`�������i�g�D�`�Ԍ`���Ɋւ����b�����j�F��v�Ȑ��̕�����p���זE�|�{���s���Ƃǂ��Ȃ邩�H�v�Ƃ��Ă��܂��B�u�F�v�̌�̃t���[�Y��O���Ɏ��g��ł��������B���̎�v�ȖړI�͍זE�̊�{�I�Ȑ�����m�邱�ƁE�m���߂邱�Ƃł��B �Ȃ��A�W�{�ώ@�̏ꍇ�͂���܂ł̒ʂ�Ɂu�\���v�Ƃ����ϓ_����s���܂��傤�B
�@�⑫�F�������͂������u�|�{�V���[���v�Ȃǂł̎��{���\�ł����A�v���E�ȕցE�m���E�ȃG�l���|�Ƃ���{�V�X�e���́u���E�l�E�ꏊ�v��I�т܂���B
�@�Ȃ��A�{�����w�K�̉���⌴���̃T�C�g��OR�R�[�h�ŁA���邢�����̉�����������N���b�N�ŎQ�Ƃ��\�ł��i��u�҂ւ̃��b�Z�[�W�F��������ƌ����̃T�C�g�j�B ���擪�s�ֈړ���
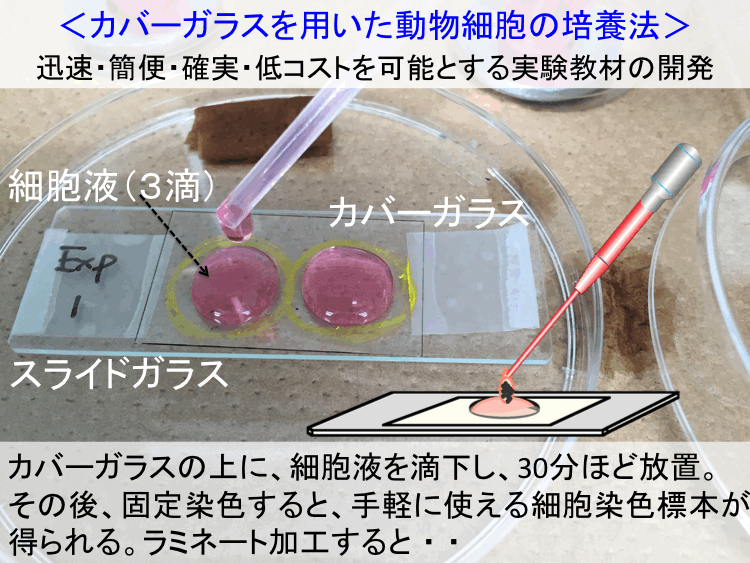
��2. �������Z�̊T�v�F�J�o�[�K���X�iCG�j��|�{��Ƃ���זE�|�{�Ƃ́�
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.1 �@�@�� Fig.2 �@�@�E Fig.3)�@
���擪�s�ֈړ����E�������ڎ�����
�@�����̏ꍇ�A�זE�|�{�����ɂ͔|�{��i�זE�̐ڒ��^���ɓK�����ގ�����Ȃ�ő��̕\�ʁi�זE�|�{�p�ɐ��i�����ꂽ�V���[��/�f�B�b�V���A�|�{�t���X�R�Ȃǁj���s���ł��B
�@
�זE�����iA, B�j�́A�J�o�[�K���X�����̔|�{��i�זE�|�{�ʁF�}3.2/Fig 2�j�Ƃ��A���̕\3.1�̊�{�S�H���i�T�v�j�Ŏ��{���܂����A�p����J�o�[�K���X�i���� CG�j�́A���ꎩ�̂��A�זE�̐ڒ��E�L�W�i�^���j�ɓK�����f�ލގ��ł��B �Ȃ��A���ʂ̃X���C�h�K���X�͕s�K���Ŏg���܂���B
�@����A�i�P��CG�|�{�@�j�́A����ł��̂܂܂̃J�o�[�K���X��p���܂��i�H��/Step1�j���A����B�i���G�`�������j�ł́A���O�Ƀ��`���Z�����[�X�i���� MC�F�����A���u�~���̑�ցF�����ȑ�p�i�j�ŏ��������J�o�[�K���X��p���܂��B���̂��߁A���̃J�o�[�K���X�i���� MC/CG�j�́A�זE���ڒ��ł��Ȃ���ԂɂȂ�̂ŁA����B�i���G�`�������j�ł́A���̕⊮�Ƃ��Ă��̃J�o�[�K���X�iMC/CG�j�Ɂu�R���[�Q���̕ϐ����[���`���i���� Gel�j�v�ŔC�ӂ̊G�����Ȃǂ�Ȗ_�ŕ`���A�זE��������ɕK�v�Ȑڒ���i�|�{��j�Ƃ��܂��B�Ȃ��A�זE�������ڒ����F���E�I���E�������锽���́u�ڒ������v�Ƃ��������ł���A�זE�̎������E�זE�^���i��e�E�`�B�E���{�j�ł��B
�@�{CG�|�{�����ɗp����זE�t�́A�|�{�J�n�O�ɉ��S�����i6500rpm 10�b�A���邢�́A1800rpm 90�b�j���A�㐟�݂���������A�V�����|�{�t�iB-Med�j�ōĕ��V�i�s�y�b�e�B���O�j���Ă���p���܂��B���R�͒Z���ԂŐڒ��L�W�^����i�߂邽�߂ł��B
�@�J�o�[�K���X�ɓH���E�|�{�ɗp���邻�̍זE�t�i���S�ĕ��V�����זE�t�j�̗ʂ́A����A�ł�1�H�i��0.05ml�j�A����B���U�H���x�i��0.3ml�j�Ƃ��Ȃ菭�ʂł��B�܂��A�|�{���Ԃ́A����A�ł�30���ȓ��Ŋ������܂����A����B�ł�60���ȏ�90�����x��K�v�Ƃ��܂��B���ӂ��Ă��������B
�@
�܂��A����Step2�i�זE�t�̒����F���S�ĕ��V�j�ł́A���ʂ̍זE�t���s�y�b�e�B���O���邽�߁A�p����X�|�C�g�̊��G�����O�Ɋm�F�E�V�~�����[�V�������Ă������Ƃ͏d�v�i�K�v�j�ł��B
�ȏ�ɗp����u�זE�����L�b�g�FCG�|�{�@�v�͎����w�K�̕t�я����u�v���E�ȕցE�m���E�����E���S�E�����I�v��O���Ƃ��ĊJ�����ꂽ�u�זE�Ȋw���猤����v�̐V�K�V�X�e���ł��B
�\3.1, �J�o�[�K���X(CG)�|�{�i����A, ����B�j�̊�{�S�H��
�H��/Step |
����A. |
����B. |
����(��) |
|
1 |
�J�o�[�K���X(CG) |
SG���CG�̍��E�ӂ��e�[�v�~�߂̌�APFP�ʼnt�~�߉~���Q�`���i���`�𗘗p�j�BCG����ɂ͖����y���̖ڈ��t���B |
MC�����ς�CG�iMC/CG�j�����L�Ɠ��l�ɏ������A�t�~�߉~�͂ЂƂB�����n��Gel��t�����Ȗ_�ŔC�ӂ̊G������`���A����30���B |
|
2 |
�זE�t�̒��� |
�{�H���̑���͎��{�ӔC�҂�O���[�v��\�҂��S������B�@1) �זE�o�b�O�ɐ����U����^�����U�����A2) �o�b�O���J�����A3) �s�y�b�e�B���O�̌�A4) ���̍זE�t�����S�`���[�u�ɉ�����B 5) ���S�����̌�A6) �㐟�݂��̂āA7) ���^�I���ŗ]�t�������A8) �^�b�s���O�B9) B-Med�������A10) ���J�ȃs�y�b�e�B���O�ōזE���ĕ��V������B�i���S�����̈Ӗ��E�����̓Z�b�g�X���Q�Ɓj |
|
|
3 |
�זE�t�̓H�� |
�~����2�H��B-Med��H�����A���������זE�t���P�H�̌�A28�����x5-30���|�{�B �|�{���Ԃ��ł���ꍇ�͂��Ў����Ă��������B |
�זE�t���~���ɂU�H�����A�K���ɐÒu���|�{90���B�W�ȂǂŊ����h�~��}��B�|�{���x��28���ȉ��ōs���܂��i�[���`�����n�����Ȃ����x�F�����ŏ\���ł��B |
|
4 |
�Œ� |
�|�{�t���̂āA�~����Fix���Q�H2�������ACV�͂Q�H3�� ����B�����B |
�|�{�t���̂āAG-Fix�͂Q�H2���B�����ACV��3�H3�������A����B�����B |
|
���\�E���́u���v���ԁv�͍H���̏��p���ԁi�\�z�j�̋L�����i��i������A�A���i������B�j �⑫�F���k��������̏ꍇ�A�Œ�t�͈��S�ȁu�|�_-�G�^�m�[���n�v�̌Œ�t���g�p���܂��B |
||||
�\3.2, ��Ȏ����ޗ�
�����t���͎���B�i���G�`�������j�p�A�ޗ��d�l�ȂǏڍׂ́uSet 5�v���Q�ƁF�R�R�A |
A.���E�@���D ��1�j �J�o�[�K���X�iCG 24x40mm�j�A��2) ���`���Z�����[�X(MC)�����ς݂̃J�o�[�K���X�iMC/CG�j�A�@��3) �X���C�h�K���X�iSG 76x26mm�j�A��4�j �p���t�B���F���M�iPFP�j�A��5�j ���ʉ��S�����@�i6500rpm���x��10�b�A���邢�́A1800rpm���x��90�b�j�A |
B.�n�t�E����. ��1�j �t�B�����o�b�O�זE�iFB�זE�@����FHLS�זE�j�A ��2�j �t�̔|�n/�|�{�t�iB-Med�j�A ��3�j �Œ�t�iG-Fix �O���^���A���f�q�h�n�j�A ��4) ���F�t�iCV �N���X�^���o�C�I���b�g�j�A��5)�@�[���`���t�iGel�j�A�@��6�j �K�v�ɉ��������`���Z�����[�X�t�iMC�j�A |
C.���i�Ȃ�.�@ ��1�j���^�g���[�iCG�|�{�K���X���e�p�j�A ��2�j�X�R�b�`�����f�B���O�e�[�v�A ��3�j�n�T�~�A ��4�j���������y���A��5�j���x�v�A ��6)�^�C�}�[�A ��7)���R�b�v�A ��8�j�I�����i��^���b�V���[�j�A ��9�j���i�v�L���A ��10�j50ml�r�[�J�[�A ��11�j���^�s���Z�b�g�A ��12�j���S�`���[�u�p�X�^���h�A ��13�j��@�A ��14�j�S�~�܁A |
 �@�@
�@�@ �@�@
�@�@
�@ �i�摜�N���b�N�Ŋg��\���F�@�� Fig.4 �@�@�� Fig.5 �@�@�E Fig.6 )
���擪�s�ֈړ���
 �@�@
�@�@  �@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.7 �@�@�� Fig.8 �@�@�E Fig.9 )
���擪�s�ֈړ����E�������ڎ�����
 �@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.11 �@�@�E Fig.12)
�y3�z�������@�ƃ}�j���A���i�����H���̎�Z����@�j
���k����������s���ꍇ�́u�ŐV�ł�PDF�����}�j���A���v��p���邱��
�������� ��{�S�H�� + �������ώ@��
Step 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5,�i�����@�j�A�זE�ώ@��
Step 1. �J�o�[�K���X(CG)�̏����A�@Step 2. �זE�t�̒����i�זE�̉��S�ĕ��V�j�A
Step 3. �זE�t�̓H���E�|�{�A�@Step 4. �Œ�E���F�i�W�{�����j�A�@�Ō�ɁAStep5. �������ώ@
���H���ʂ̕K�v���i�i�S�l/�ǂ�����̕K�v���ʁF������d�l��Set5���Q�ƁF�R�R�j �� |
Step 1�F�J�o�[�K���X�̏���
|
Step 2, 3�F�זE�t�̒����ƓH���|�{ �i����A, B���ʁj
�@�����F�זE�t��|�n��z�z���鎆�R�b�v/�v���J�b�v�́A�K���]�|�h�~��A���s�����Ɓj |
Step 4�F�Œ�E���F�i����A, B���ʁj
|
����i�i����A, B���ʁj
|
�⑫�F�h��3���X�|�C�g�̕K�v���ƒ��ӎ���
|
�E�������ڎ�����
|
|
�@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.13 �@�@�� Fig.14 �@�@�E Fig.15 )
���擪�s�ֈړ����E�������ڎ�����
Step 1. �זE�|�{�p�J�o�[�K���X�iCG�j�̏���
�@�k�ړ��FStep 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5,�i�����@�j�A�זE�ώ@���l
���� A�i�P��CG�|�{�j�̏ꍇ.�i����B:CG���G�`�������͉��L�j
�i���߂Ă̐l�́A�|�{�T�[�N�����u�P�`���v�ōs�����K���Ă���j
- �� �X���C�h�K���X�̏�ɁA�J�o�[�K���X�̒Z�ӈ搔mm���e�[�v�Ŏ~�߂�i�e�[�v�̊p�͏d�ː܂�F�������Ղ�����j�B �� �ЂȌ`�i�䎆�j�ɒu���A�p���t�B���F���M�Ŗ�1.5cm�̉~���Q�`���i���}3.3�A�t�~�߃T�[�N���Ȃ̂ł�����蒚�J���d�ˏ����ő����Ƃ���i�d�v�j�B ���J�o�[�K���X����ɂ͖����y���Ŗڈ��t�L�i�זE�ʂ̊m�F�p�j�B
- �� ����CG�|�{�K���X�͎��i�v�L����~�������g���[��10cm�V���[���Ȃǂ̏�ň����B�� ���H���܂ŕۊǁB
�}3.3�A�t�~�߃T�[�N���̐��`�F�p���t�B���F���M�ŏd�˕`���A���J�ɑ����ɂ���B
�i�摜�N���b�N�Ŋg��\���F Fig.10 )
�E�E�E���擪�s�ֈړ����E�������ڎ������E�E�E
���� B�iOEKAKI Exp�j�̏ꍇ.
�@�F���`���Z���[�X(MC)�����ς݃J�o�[�K���X�|�{��̏����F�[���`���h���E �E �E �E �E �E �E �E �E�ȏ�� Step 1 �I���E �E �E �E �E �E �E �E �E �E �E
- �� MC�����J�o�[�K���X�iMC/CG�j���X���C�h�K���X�Ƀe�[�v�~�߂��A���p���t�B���y���Ŗ�2cm�̉~����`���B
- �� �[���`���t�������n�����A���Ȗ_����mm��[��Z���i5�b�j�B����[�����i�v�L�������b�ԕt���]�t���\���ɏ����i����͑�j�B
- ��}�F�����̃[���`���Ȗ_�ʼn~���ɔC�ӂ̐}����`���B
�|�C���g�F�������E�����E�����M���ŕ`�� �B���h��̓_���B
- �����R�����i10���ԁj��A���X�ɐ�@�ő���20�����x�A���S�Ɋ���������i�d�v�j�B�� �����i�͎��H���܂ŕۊǂ���B
Step 2 (����). �זE�t�̒��� (�זE�̉��S�ĕ��V)�@�E�E�@Step3�̒��O�ɍs��
�@�k�ړ��FStep 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5,�i�����@�j�A�זE�ώ@���l
- �{�H���i�זE�t�̒����j�̑���́A���{�ӔC�����Ǒ�\�����S�������{����i�S���ł͂Ȃ��j�B
- �{�H���ł͎�������K�v�ȃX�|�C�g������s���̂ŁA���O�ɁA�P�j�X�|�C�g����u�t�ʁF0.5ml���݁v�̊m�F�A�Q�j�X�|�C�g�ɂ��s�y�b�e�B���O�i�|���s���O�F�t�̏o������j�̊��G���m�F����B
- ���L�̑����P�j�͎�u�ґ�\��ӔC�����s���A�Q�j�ȍ~�̓O���[�v�i�ǁj�̑�\�����s���B���̑��̐l�̓A�V�X�^���g�i������@�̊m�F�╨�i�̎n���j�Ȃǂ�S������B
���t�B�����o�b�O�זE�̉t�ʂ͂P�Qml/�p�b�N�ł���B
 �@�@
�@�@ �@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.16 �@�@�� Fig.17 �@�@�E Fig.18 )
���擪�s�ֈړ����E�������ڎ�����
- �t�B�����o�b�O�iFB�j�זE�i12ml�j�̕��V���U���i�ӔC�҂��S���j �yFig18�z�@
���P�j�זE�o�b�O�̒��ɒ������ۂ���i�זE�j���ώ@���A�o�b�O�������U����^���A�זE�̉�V������B ���Q�j�傫�ȉt�B�����ɕt���̎��́A������x�A�����U�����s���B
���R�j�E�}�F�זE�o�b�O���n�T�~�ŊJ�����A�X�|�C�g���������݁A�T����x�s�y�b�e�B���O�i�t�̏o������j���s���B ���S�j�ڎ��m�F���u�����E�傫���E�ڗ��v���͍ēx�s�y�b�e�B���O���s���B
���T�j���̍זE�t�i12ml�j���A�]�|�h�~�����f�B�X�|���J�b�v�i�V�i�E���^�j�Ȃǂɕ�������i�Ⴆ�A���E�E��̎�u�҂ɑΉ�����6mlx�Q�J�b�v�j�B���U�j���̃J�b�v�ɂ��X�|�C�g�����ꂼ���Q�{�Y����/�����i���̑�����S���҂����S�`���[�u�ɍזE�t�����邽�߂̃X�|�C�g�j�B
���V�j ���l���|�n���J�b�v2�ɕ����i�S���Ҏ��ɗ���̂��V�i�X�|�C�g���e�Q�{�Y����j�B
- �זE�t�̕����i�ǒS���҂P�j
�� �P�j�S���҂́A���S�`���[�u�P�{�i�Qml�T�C�Y�j�j�����Q���A�J�b�v�����זE�t1.5ml������B�� �Q�j�L���b�v����������y���Ŗڈ�������B�@
�i�� ����B�̏ꍇ�́A�Q�{�̉��S�`���[�u�Ɋe2ml������B�j
 �@�@
�@�@ �@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.19 �@�@�� Fig.20 �@�@�E Fig.21�j
���擪�s�ֈړ����E�������ڎ�����
Fig.20�̕⑫�F�זE�����L�b�g������A�S�A5���ڂɂ͍זE�Z�x�������Ȃ��Ă��邩���BCG�P���|�{�i����A�j�ł͒Ⴂ�זE�Z�x�Ŏ������s�����߁A���S������̍זE�y���b�g���傫�����iFig.20���Q�Ɓj�́A�זE�Z�x���K�ʂɂȂ�悤�ɔ|�n�ōĕ��V��ɓK�Ɋ�߂��čs���Ɨǂ����ʂƂȂ�͂��B
- ���S�����i�ǒS���҂Q�j�yFig19�z�@
�����S�@�ɁA�`���[�u��Ίp���E�o�����X��ԁi�قړ����d�ʁj�ŃZ�b�g����B
�� 6500rpm,10�b�i���邢��1800rpm��80�b�j�̉��S�������s���i�X�C�b�`ON�A10�b���OFF�j�B
�����F ���S������̍זE�́A�`���[�u�̒�̈ꕔ�ɒ��a�E�W�܂��Ă���i�y���b�g�����Ă���j�B���̂��߃`���[�u�����S�@������o�����͒��J�ɍs���i�����͂������ƍזE�y���b�g�������̂Œ��Ӂj�B
- ���㏈���ƃ^�b�s���O�i�ǒS���҂R�j�yFig22�z�@
�� �t���̂Ă鎆�R�b�v��p�ӂ���B�S���҂́A
�� �P�j����ŃL���b�v���J���A�f�����t���܂ɂ����㐟�����̂Ă�B�@
�� �Q�j���̂܂܂łT�b�قNjt���܂܂ɂ�����A�o�����c�t�����i�v�L���łł��邾���z������B �� �R�j�`���[�u��ɒ���t���Ă����זE�y���b�g��f�����m�F�i�傫�����j�B
�� �S�j�L���b�v����A�`���[�u�̒���e�[�u�����C�����ȏ�ɋ����i���Ȃ苭���j20��ȏ�ł��t����i�^�b�s���O�����F�זE�y���b�g���ق����j�B�������ցB
 �@�@
�@�@ �@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.22 �@�@�� Fig.23 �@�@�E Fig.24 )
���擪�s�ֈړ����E�������ڎ�����
- �זE�̍ĕ��V�i�ǒS���҂R�j�yFig22�z�@
�� �S����1,2�����i�m�F�F������X�|�C�g�i��p�����ǁj�Q�{�B�����̂P�{�ɂ́u�|�n�J�b�v�v�����|�n���̎悵�Ă���i����A��3ml�A����B��2.5ml�j�B�����ɐV�i�X�|�C�g�Q�{��ǂɎ����A��A��p�����ǂɓ���Ă����B
�� �P�j ���S�`���[�u�̃L���b�v���J���A����A�`���[�u�ɔ|�n1.5ml���X�|�C�g�ʼn�����B
�@�@�i�� ����B�̏ꍇ�͂Q�{�̃`���[�u�ɂ��ꂼ��1ml��������F�זE�Z�x�͂Q�{�ɂȂ�j�B
�� �Q�j ���̃X�|�C�g�ŁA�������ڂ�Ȃ��悤�ɁE�A���Ă��Ȃ��悤�ɁA������蒚�J�Ƀs�y�b�e�B���O(�זE�̒P�����U)���T����x�s���A�זE�V������B
�� �R�j���̍זE�t���u���g�p����p�������v���S�ʂ��ڂ��������B
�� �S�j��p�����ǂł́u�������ڂ�v�̐S�z���Ȃ��̂ŁA���߃|���s���O�i�s�y�b�e�B���O�j�ōזE�t���\���ɒP�����U������B �� ���̍זE�t�����A����ꍇ�͂��������s�y�b�e�B���O��������i�זE�͒P�����U����j�B�i�� ����B�i�Q�{�`���[�u�j�ł����l�ɑ��삷�邪�A�ĕ��V�t�͍��v2ml/��p�����ǁA�ɂȂ�j�B
- ���������璆�f���邱�ƂȂ��i�x�ނ��ƂȂ��j�A���̍H���iStep 3�j���J�n����B
�⑫�F����A��B���i�s�ɍs���ꍇ�̍זE�����@�i�S�l���F����j�@
|
�E �E �E �E �E �E �E �E �E�ȏ�� Step �Q �I���E �E �E �E �E �E �E �E �E �E �E
Step �R. �זE�t(���S�ĕ��V�t)�̓H���ƍזE�|�{
�@�k�ړ��FStep 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5,�i�����@�j�A�זE�ώ@���l
���ӁF�X�|�C�g�͗��Ă��i45�x�ȏ�Łj�g�p����B�H���̎������������グ�u�t�H�v�����悤�ȍ����ōs���B�Ў��Y���Ĉ��肳�����삷��B�C�A������Ȃ��悤�ɒ��ӂ��đ��삷��B
�����O�̊m�F�F���Òu�|�{����ꏊ���m�F�B����A�ł͉��x��28-33���i���{���x�́Q���j�B��Step 1�ō쐬����CG�|�{�K���X�̍��E�i�|�{�ʁj�͔|�{���Ԃ̍��قȂǂɎg���i�}���Q�Ɓj�B
�R�����g�F�����ł͍���30���|�{�Ƃ��邪�A�����\�Ȃ�A45�����x�|�{����ƌ��Ⴆ��悤�ȐL�W����������͂��B
�@�@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.25 �@�@�E Fig.26 �@�@)
���擪�s�ֈړ����E�������ڎ���������A. �t�̔|�n�ƍזE�t�̓H���E�|�{�i�Q�T�[�N��/CG�̏ꍇ�j
- ���P�j ���~�����ɔ|�n�iB-Med�j���X�|�C�g��2�H�A���Q�j ������Step2�Œ��������זE�t�i���S�ĕ��V�t�j1�H���H���B���R�j����̏ꏊ�Ɉړ��E�Òu���|�{�J�n�i�������L�^�j�B
- �� �E�~�����ǂ̂悤�Ɏg�������Ċm�F����B�@�Ⴆ�A20����ɁA
- �� �E�~��1�j�Ɠ���������s���A5-10���Ԕ|�{����B
- �� �\���F�܂�A5-10����A���E���ɌŒ�(Step4)����B�����̕K�v�ȕ��i�ƕ��@�S���Ċm�F����B
����B�iOEKAKI�j. ���S�ĕ��V�����זE�t�̓H���Ɣ|�{
�����i�d�v�j�F���������h���[���`���͈ȉ��̍זE�|�{���ɋz���c������̂ŁA�|�{���x��30�����z����ƃ[���`������Ղ��Ȃ�A���邢�͍זE���[���`���������������Ă��܂��B���̂����|�{���x�͂Q�W�����z���Ȃ��������d�v�B�]���āAStep 1�̎��̓[���`���̌��h��͌��ւł���B
- Gel�h���ς�MC/CG�|�{�K���X�̉~�����ɁAStep 2�Œ��������זE�t���u6�H�v�H������B�������L�^�B
- ����̏ꏊ�ōŒ�90���͔|�{���邪���̂悤�Ȋ����h�~��}��B ���܂�A�����ȔG�ꎆ��CG�|�{�K���X�̑��ɒu���A�V���[���Ȃǂ�킹�����h�~�B���ӁF�G�ꎆ�ƃK���X���ڂ���ƍזE�t���Z���E��������B
- �� �����|�{�ŗǂ����A�������25�����x���]�܂����B�`�F�b�N�i�Q�Q���j�B�@�R�O���ȏ�ł̓[���`�����c�����זE�������������F28���ȉ��ɂ���B�� 60���ȏ�o�߂������ɂƂ��Ėڎ��m�F���\�B�t����ꂽ����߂Ĕ|�n�iB-Med�j��H�����A�����h�~�Ŕ|�{���p������B
�E �E �E �E �E �E �E �E�ȏ�� Step �R �I���E �E �E �E �E �E �E �E �E �E �E
Step 4 (����). �Œ�E���F
�@�k�ړ��FStep 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5,�i�����@�j�A�זE�ώ@���l
-
���ӁF���Q�Ȑ|�_-�G�^�m�[���n�Œ�t��p����B�Œ�t�E���F�t�͔��Ȃ��悤�ɒ��Ӂi�t�������炷������j�B�e�[�u��������B���i�m�F�i�S���҂P,2�j�F�g�p�ς݃X�|�C�g�Q�{�𐅐�E���肵�A�K���X�������ǂɌŒ�t�Ɛ��F�t���̎悷��i����A�͊e1.5 ml�A����B�ł͊e1.0 ml�j�B�����p�̐��J�b�v���Q���p�ӁB���v���B
�@ �@�@�@
�@�@�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.27 �@�@�@�E Fig.28 )
 �@�@
�@�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.29 �@�@�E Fig.30 )
���擪�s�ֈړ����E�������ڎ�����
- ���P�j ���~���i�g���[�j�̏�Ɏ��i�v�L���𐔖��d�˂ŕ~���B���Q�j CG�|�{�K���X�����̏�ɒu���B���X���C�h�K���X�̒��ӂ��ڂ�����ԂŒZ�ӂ𗧂ĂāA���̂܂ܐ��b���u����i�|�n���z�������j�B�����h�~�F�������ցB
- ���P�j �G��̂Ȃ����i�v�L����ɖ߂��A���Q�j�Œ�t(Fix�F�����t)���X�|�C�g�𗧂ĉ~�������Q�H�������H���B���R�j �Œ�t���T�[�N���̊O�ɗ���o�������t���ڂ��Ă��Ȃ��ꏊ�ɉ��߂ēH������B�@���S�j ���̂܂�3���i�ȏ�j�����i���u�j����B�@���T�j ���̊ԂɎ��̑���i����j�̐��J�b�v�Q�Ȃǂ�p�ӂ���B
- ���P�j �Œ�t�i�����t�j���u�p�t�����F���L�������R�b�v�v�Ɏ̂āA���Q�j ���i�J�b�v�j�ɒЂ��A�₳�����h����Ȃ���T�b�قǐ���B�@���R�j �V�������J�b�v�ł�����x�B�@���S�j �P�j�Ɠ����悤�ɁA���i�v�L���ɗ��Đ����z���B
- ���P�j �g���[�ɖ߂��A���Q�j ���F�t�i�t�j��H��(����A���Q�H�A����B���R�H) �B�@���R�j���F�t������o�����͉t���ڂ��Ă��Ȃ��ꏊ�ɉ��߂ēH���B���S�j �R���i�ȏ�j���F�B���T�j���̊ԂɎ��R�b�v�̐���ς���E��������B
- ���P�j ���F�t������́u�p�t����v�Ɏ̂āA ���Q�j �����R�b�v��5�b�قǐZ����B���R�j �y�������A���̐��J�b�v�ɓ��l�ɐZ���A����B
- ���P�j�e�[�v�J�ɔ������A���Q�jCG�̍זE���F�ʂ���ɂ��Ď��i�v�L����Ŋ����i�����j�B���邢��Step5�ցB
�E �E �E �E �E �E �E�ȏ�� Step 4 �I�����擪�s�ֈړ����E�������ڎ������E �E �E �E �E �E �E �E
Step 5 (����). �������ώ@�i�����ώ@�̂��߂̐������@�j
�@�k�ړ��FStep 1, �@Step 2, �@Step 3, �@Step 4, �@Step 5,�i�����@�j�A�זE�ώ@���l
 �@�@�@
�@�@�@ 
���擪�s�ֈړ��� �E�������ڎ�����
- �� ������@��������X���C�h�K���X�����^�I���̏�ɒu���A�� �K���X�����ɐ��P�H��H���B
- �� �J�o�[�K���X�̍זE���F�ʂ����ɂ��āu�H�����v�̏�ɒ��J�ɍڂ���i�J�o�[�K���X�͎��R�ɒ���t���j�B
- �� �K���X�\�ʂ̐��G������i�v�L���Œ��J�ɋz�������B�������A�J�o�[�K���X�������t���Ă͂����Ȃ��B
- �����������́u�������W�{�v���������ɃZ�b�g����{�E���{���Łu�\���F�v�f�̔z�u�ƌq����v�̊ϓ_����ώ@�B
�������ώ@�������̕����W�{�̊ώ@�@��\�����@�́u���������Ɖ���v�A���邢�́u�W�{�̌����E�l�����E�i�ߕ��v���Q�Ƃ��Ă��������B
- �������זE�W�{�i�J�o�[�K���X�j�������́A��������CG�ʂ𐅕�������B���邢�́A�����R�b�v�̐��ɐ����Z���A�y���h����Ǝ��R�ɔ����ꗎ����͂��B���s���Z�b�g�Ȃǂ�p����CG�J�Ɏ��o���B���������ĕۑ��B
- �����W�{�͕����Ȃ��ł��ώ@���\�ł��邪�A��薾�Ăɂ���ɂ͉��L�ŕ����W�{�Ƃ���B
�⑫�F�h���C�����W�{�̍���
�����W�{�����ꍇ�A���̕����܂͉��ϕi�i�܃g�b�v�R�[�g�F100�~�V���b�v�j�̒��������i60�b�Ŋ����j��p����B���̑��̕����܂�p����Ǝ��Ԍo�߂ƂƂ��ɒE�F����̂Œ��ӁB
�P�j���Y��ȃX���C�h�K���X�̒����Ƀg�b�v�R�[�g�����ʓH������B�@
�Q�j��CG�|�{���F�W�{�̍זE�ʂ����ɂ��ăg�b�v�R�[�g�̏�ɍڂ���B�@
�R�j���\�~�d���Ȃnjy���I�������J�o�[�K���X�̏�ɍڂ��A������薧��������B
��}�F�J�o�[�K���X�|�{�@�ɂ����F�זE���i�N���X�^���o�C�I���b�g���F�j
�@�{�҂̕��@�ō쐻������30���|�{��̋��ޔ|�{�זEFHLS���B���F�זE�ɂ́A�זE�����̉t�E���U������邪�A�זE�j�A�j���́A�זE���i�i�A�N�`�����j�A������t���ȂǁA�זE�ڒ��̗l�q���{�I�ȍזE�`�Ԃ����ĂɊώ@�����B�����Ƃ́A���F�����Ⴂ�זE�̕Ή����ł���A��v�ȍזE���튯�͊ώ@���ꂸ�A�����L�W�����זE���ƍזE���i�ɂ��\������A���̔g�����^���ɂ��ړ����\�Ƃ��镔���B�ڒ��L�W�����n�ȍזE�A�܂�|�{�����ȂǁA�ł͍זE�͋���̂܂ܔZ������ώ@�����B�ڍׂ́u�W�{�̌����E�l�����E�i�ߕ��v�A���邢�́u���������Ɖ���v���Q�ƁB
�@�u�ŐV�ł�PDF�����}�j���A���v���Q�ƁB
�����ޗ��̈Ӗ��E�Ӌ`�E�d�l�A�܂��A�ޗ��̕K�v���ʂ̎Z�o�@�Ȃǂ�
�����w�K�̎��{�v�̂́u�Z�b�g�T�v���Q��
���̃V�[�g�͏I���
��������������������������������
��31-33��
��
�@  �@
�@ �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.31 �@�@�� Fig.32 �@�@�E Fig.33 )
���擪�s�ֈړ����E�������ڎ�����
��34-36��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.34 �@�@�� Fig.35 �@�@�E Fig.36 )
���擪�s�ֈړ���
��37-39��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.37 �@�@�� Fig.38 �@�@�E Fig.39 )
���擪�s�ֈړ���
��40-42��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.40 �@�@�� Fig.41 �@�@�E Fig.42 )�@
���擪�s�ֈړ���
��43-45��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.43 �@�@�� Fig.44 �@�@�E Fig.45 )�@
���擪�s�ֈړ���
��46-48��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.46 �@�@�� Fig.47 �@�@�E Fig.48)�@
���擪�s�ֈړ���
��49-51��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.49 �@�@�� Fig.50 �@�@�E Fig.51)�@
���擪�s�ֈړ���
��52-54��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.52 �@�@�� Fig.53 �@�@�E Fig.54)�@
���擪�s�ֈړ���
��55-57��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.55 �@�@�� Fig.56 �@�@�E Fig.57)�@
���擪�s�ֈړ���
��58-60��
��
 �@
�@ �@
�@
�i�摜�N���b�N�Ŋg��\���F�@�� Fig.58 �@�@�� Fig.59 �@�@�E Fig.60)�@
���擪�s�ֈړ���
����������
��

